武科大網訊 11月22日,我校6774澳门永利祝海川副教授、北京大學第三醫院林堅研究員和軍事醫學研究院鐘武研究員作為共同通訊作者,在國際腫瘤和血液腫瘤權威期刊J Hematol Oncol(IF 28.5, 中科院一區Top期刊) 發表了題為:Direct inhibition of dioxygenases TET1 by the rheumatoid arthritis drug auranofin selectively induces cancer cell death in T-ALL的研究論文。北京大學第三醫院陳龍副研究員、我校研究生任安琪、趙院為論文的共同第一作者,我校張同存教授和北京大學生命科學學院伊成器教授為本論文提供了技術支持。
表觀遺傳調控在血液腫瘤中發揮着重要作用,尤其是DNA甲基化異常調控對血液腫瘤的發生、發展都有着顯著影響。T細胞急性淋巴細胞白血病(T-ALL)是一種惡性的血液腫瘤,現有藥物治療預後差,且易複發。前期的研究顯示DNA表觀遺傳與T-ALL的發生和發展存在相關性,但具體的機制和靶向治療藥物仍然有待揭示。
本項研究針對高複發和預後差的T-ALL展開,首先發現 DNA去甲基化酶TET1在臨床T-ALL病人樣本中顯著高表達,且與患者預後呈現負相關。細胞和動物水平實驗表明,特異性的降低TET1,可以有效的抑制T-ALL的生長與進展,從而預示T-ALL細胞的死亡與TET1調控的DNA表觀遺傳的改變緊密相關,而TET1的高效特異性抑制劑有可能是T-ALL的有效治療策略。
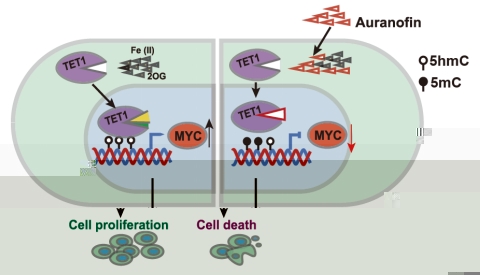
針對目前臨床上TET1高效抑制劑缺乏的現狀,研究團隊利用結構引導虛拟篩選和細胞水平高通量藥物篩選的策略,在超過2000個的FDA批準的上市藥物庫中,發現已批準上市的治療類風濕性關節炎的藥物-金諾芬(Auranofin)可以高效、特異性的抑制TET1蛋白酶活及下遊功能。進一步研究發現,Auranofin通過與底物競争性結合底物結合“口袋”,從而抑制TET1的催化活性。全基因組水平的DNA表觀遺傳(5-甲基胞嘧啶和5-強甲基胞嘧啶)測序進一步證實TET1的高效抑制導緻多種基因啟動子區DNA去甲基化過程的下調(5mC水平上調,5hmC水平下調),暗示TET1抑制劑可能通過甲基化抑制特定基因的表達從而調控T-ALL細胞的增殖;基于此設想,團隊進一步證明TET1抑制通過表觀遺傳調控了原癌基因c-Myc表達的下調,從而介導了T-ALL的死亡。
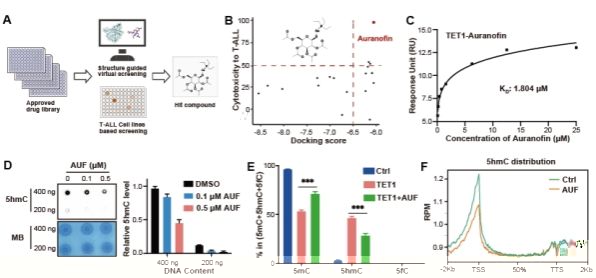
本研究進一步揭示了TET1是T-ALL的潛在治療靶點,并首次發現了治療類似風濕的藥物Auranofin是TET1的高效特異性抑制劑,可以作為T-ALL的潛在治療藥物,目前該藥物應用于T-ALL的治療正在積極推進臨床有效性的研究,将來有望真正應用于T-ALL的臨床治療。同時本研究揭示了TET1通過DNA表觀遺傳和c-Myc信号通路調控T-ALL的機制,為更多T-ALL治療藥物的發展提供了機制支撐。(生科院)
原文鍊接:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-023-01513-6
